美国兽药是如何上市的?
中国兽医药品监察所(农业农村部兽药评审中心) 孙雷 李丹 徐倩 王亦琳 叶妮 孙红洋 汪霞
世界各国的兽药管理因国情不同而有所不同,国外主要发达国家的兽药和人用药品一般由统一的机构负责管理。美国的兽药主要由卫生和公众服务部(HHS)的食品药品监督管理局(FDA)进行管理,具体由FDA下设的兽药中心(CVM)负责。美国的兽用生物制品由农业部(USDA)负责管理;兽用麻醉药由毒品管制局(DEA)负责管理;杀虫剂、杀真菌剂、灭鼠剂等由环境保护局(EPA)负责管理。
美国兽药管理的相关法规主要有《联邦食品、药品及化妆品法》(FFDCA)和《联邦法典》第21条的食品和药品部分。根据FFDCA规定,在美国上市的新兽药都要经过FDA的批准。FDA的新兽药批准过程是开放的,申请人可在研发早期与兽药中心进行交流,如果申请人有了初步的研发目标药物及其靶动物、适应证,可以向兽药中心的新兽药评估办公室进行新兽药临床试验申请、讨论新兽药审评所需费用、讨论新兽药研发计划等。美国2003年通过的《兽药申请人付费法案》授权兽药中心可以向申请人收取费用用于兽药审评工作。申请人在新兽药临床试验申请阶段收集到足够的试验数据和资料来证明兽药的安全性和有效性,并具备新兽药申请条件时,可以向FDA进行新兽药申请,FDA新兽药申请关注的主要技术内容是:①靶动物安全性;②有效性;③人类食品安全;④化学、生产和控制(CMC);⑤环境影响。
美国FDA兽药上市许可主要通过批准、附条件批准、索引和紧急使用授权(EUA)四种途径,主要有原始批准、补充批准、撤回批准、标签变更、申请人变更、适用性请愿书等多种方式。
本文重点介绍美国FDA兽药上市许可的四种途径,汇总FDA批准兽药绿皮书中2018年1月至2024年3月这6年多时间内原始批准的新兽药申请、简化新兽药申请和附条件批准的兽药品种信息,并进行统计分析,希望能对我国新兽药的研发和审评工作有一定的指导意义。
美国FDA兽药上市许可途径
美国FDA兽药上市许可主要有以下四种途径:
批准
包括新兽药申请和简化新兽药申请。新兽药申请适用于创新化学药物及其产品、新的治疗用途即新的适应证、新的用法用量、新剂型和新复方制剂。简化新兽药申请适用于仿制药、专利过期的处方药和已上市非处方药的长效控释制剂。
附条件批准
适用于某些次要物种使用的兽药或主要物种的次要用途。美国FDA将“次要物种”定义为马、狗、猫、牛、猪、火鸡和鸡七大主要物种之外的动物,包括农业上的绵羊、山羊、鲶鱼和蜜蜂等以及非农业上的动物园动物、观赏鱼、鹦鹉和雪貂等,例如治疗绵羊或山羊疾病的药物就有资格获得附条件批准,因为这两种动物在美国都是次要物种。美国FDA将主要物种的次要用途定义为马、狗、猫、牛、猪、火鸡和鸡七大主要物种每年很少发生或每年在有限地理区域内少量动物发生疾病使用药物治疗的情况,例如一种用于控制犬骨癌疼痛的药物有资格获得附条件批准,因为在美国每年通常不到70000只犬患骨癌。
附条件批准的兽药按照FDA新兽药申请程序进行了评审,根据标签说明书使用是安全的,并且具有“合理的有效性预期”,但该药物尚未达到完全批准的有效性标准。附条件批准的有效期为1年,之后申请人需每年向FDA提出申请,最多可以再延迟4年。在这5年内,申请人可以合法销售兽药,但必须继续收集有效性数据,提交并通过FDA的评审后该药才可以获得全面批准。
索引
是《次要物种用未经批准但合法上市的新兽药索引》的简称。索引中的药物未经批准,但可以合法上市,用于某些次要物种的特殊用途,例如非食品动物的次要物种如宠物鸟、宠物仓鼠和观赏鱼、雪貂等,这些动物通常不被人类食用;或者食品动物的次要物种的非食用幼龄阶段,例如牡蛎卵(幼龄牡蛎),由于人们一般不吃牡蛎卵,因此可以对治疗牡蛎卵疾病的药物进行索引,但对治疗人们常吃的成年牡蛎疾病的药物则无法进行索引。
药品进入索引的过程与药品审批过程截然不同,索引在很大程度上依赖于FDA之外的专家组,专家们审查药物在特定次要物种中的安全性以及在预期用途中的有效性,专家组所有专家都必须同意根据标签使用时该药物对受治疗动物的益处大于风险。然后,如果FDA同意专家组的意见,则该药物就可以被添加到索引中。
紧急使用授权
适用于突发公共卫生事件时所需医疗产品的使用授权。在国家受到包括传染病在内的化学、生物、放射性和核威胁公共卫生紧急情况下,FDA可以授权未经批准的药品或未经批准使用的已批准药品用于诊断、治疗或预防严重的或威胁生命安全的疾病等。
近年来美国FDA原始批准的兽药统计分析
近年来美国FDA原始批准的兽药
2018年1月至2024年3月,FDA批准兽药绿皮书中原始批准的新兽药申请、简化新兽药申请和附条件批准共有146个兽药品种,其中55个是新兽药申请,83个是简化新兽药申请,8个是附条件批准。
按批准动物统计
2018年1月至2024年3月,美国FDA原始批准的146个兽药品种中,用于犬的品种最多,有57个(全是处方药);其次是牛,有44个(9个处方药,19个兽医饲料指令药和16个非处方药);排第三的是猫,有30个(全是处方药);排第四的是鸡,有15个(8个兽医饲料指令药和7个非处方药);排第五的是猪,有11个(5个处方药,1个兽医饲料指令药和5个非处方药);排第六的是马,有9个(全是处方药)。不难看出,近6年多来FDA原始批准的兽药品种中,用于犬和猫等宠物的药物品种较多,有87个;用于牛、鸡和猪等食品动物的药物品种较少,有69个;用于马的最少,有9个。不难看出,犬、牛、猫用药物品种占据前三位,鸡用药物品种也有一定的数量,猪、马用药物品种相对较少。详见图1。
按批准用途统计
2018年1月至2024年3月,美国FDA原始批准的146个兽药品种中,抗寄生虫药最多,有66个(其中抗球虫药有39个);抗菌药次之,有49个;镇静镇痛类药有20个(其中有2个单抗注射液),可以看出,抗寄生虫药和抗菌药仍占很大的份额,镇静镇痛类药也有一定比例。同时,新兴的宠物专科用药在市场中不断发展壮大,其中皮炎用药有4个(犬用奥拉替尼咀嚼片和环孢素胶囊、犬和猫用环孢素溶液)、糖尿病用药2个(猫用贝沙格列净片和维拉格列净口服溶液)、心脏病用药2个(犬用螺内酯和盐酸贝那普利咀嚼片以及匹莫苯丹咀嚼片)、肿瘤用药2个(犬用Tigilanol Tiglate注射液和维地奈索包衣片)、癫痫病用药2个(犬用溴化钾咀嚼片和苯巴比妥片)、焦虑恐慌症用药2个(猫用普瑞巴林口服溶液和犬用盐酸氯米帕明片)、胰腺炎用药1个(犬注射用夫扎拉迪钠)、噪音厌恶症用药1个(犬用伊匹妥英片)、高血压用药1个(猫用替米沙坦口服溶液)、安乐死用药1个(犬用戊巴比妥钠和苯妥英钠注射液)以及哮喘用药1个(马用环索奈德鼻内吸入喷雾剂)等,见图2。
讨论
兽药审批过程
从上文可以看出,美国从新兽药研发早期开始,申请人就与兽药中心相关部门进行临床试验申请,进行沟通交流,探讨药物研发计划等,避免研究开始后造成不必要的时间、经费和试验动物等浪费。我国农业农村部兽药评审中心实施的新兽药临床试验备案制、每周定时的电话咨询制、网上发布沟通交流常见问题以及近期公开征求“兽用化学药物研发服务需求”拟建立的兽药研发服务系统等,和FDA新兽药审批前的沟通交流机制是类似的。另外,美国兽药中心可以向申请人收取费用用于兽药审评工作,而我国截止目前进行新兽药注册审评仍是不收费的,这也是我国和美国在新兽药审批方面不同的地方。美国FDA还针对动物园动物、宠物鸟、观赏鱼、雪貂等次要物种动物用药给出了审批办法,可以采用附条件批准或索引的方法,简化了审批流程,保证了尽可能多种类的动物有药可用,对我国小物种动物用兽药注册审批工作有一定的借鉴意义。
批准兽药种类
从近年来美国FDA原始批准的兽药品种来看,新兽药申请的原研药较少,简化新兽药申请的仿制药较多,这方面和我国基本是一致的。FDA批准用于犬和猫等宠物的品种较多,用于牛、鸡和猪等食品动物的品种较少,同时批准了不少的马用兽药,而我国批准用于猪、鸡和牛等食品动物的品种较多,用于宠物的兽药近年有增加的趋势,马用兽药批准的很少,这与我国的动物养殖结构和用药需求有关。FDA批准用于抗寄生虫的药物多,用于抗菌的药物次之,镇静镇痛类药物占有一定的数量,宠物糖尿病、心脏病、肿瘤病、癫痫病、胰腺炎等专科用药不断发展壮大;我国批准用于抗菌的药物多,抗寄生虫的药物次之,不过近年来我国抗寄生虫的药物有增加的趋势,也有少量宠物专科用药品种。另外,FDA批准了多个含有用于提高饲料转化率的盐酸莱克多巴胺以及用于抑制母牛发情的醋酸美伦孕酮的饲料添加药物,但是这两种药物均属于我国农业农村部公告第250号中禁止在食品动物中使用的药物,这也是我国与美国在兽药管理方面显著差别之一。
处方药管理
美国FDA将兽药分为处方药、非处方药和兽医饲料指令药三种。如果兽药中心确定药物标签上写出了足够的“使用说明”,非兽医即可以安全有效地使用,那么该药就可以作为非处方药销售。如果不是,就必须以处方药或兽医饲料指令药的形式销售。这两类药物都需要在兽医监督下才能安全有效地使用,它们的主要区别在于药物是否用于动物饲料,用于动物饲料时就批准其为兽医饲料指令药,不用于动物饲料时就批准为处方药物。可以看出,兽医饲料指令药物虽然要在兽医监督下使用,但不是处方药,不涉及处方药相关的州药房法。而我国将兽药分为处方药和非处方药两种,也就是说,我国处方药没有区分是否通过饲料添加途径给药这种方式,这也是我国和美国在兽用处方药管理方面不同的地方。另外,2014年美国FDA宣布用三年时间从2017年开始禁止饲料中使用促生长抗菌药物,但是保留兽医饲料指令药;2019年我国农业农村部第194号公告要求促成长抗菌药物在2020年全部退出,但是2020年我国农业农村部第330号公告发布了《废止的药物饲料添加剂品种增加治疗用途注册资料要求》,这些废止的促生长用途抗菌药物可以转为治疗用途进行注册并以兽药处方药方式在兽医临床中使用。
美国FDA的兽药管理有其完整的监管机构、健全的法规体系以及系统的审批制度和服务体系,美国FDA的兽药上市许可途径以及新兽药发展方向对我国的新兽药研发和审评工作也有一定的指导意义。
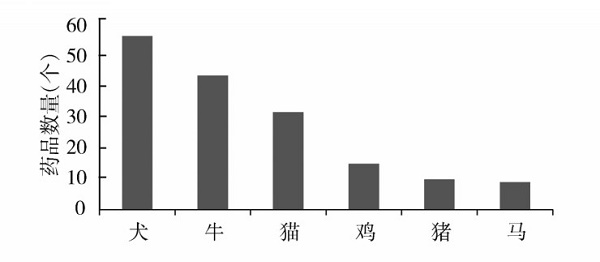
图1 2018年1月至2024年3月FDA
原始批准的不同动物的药品数量
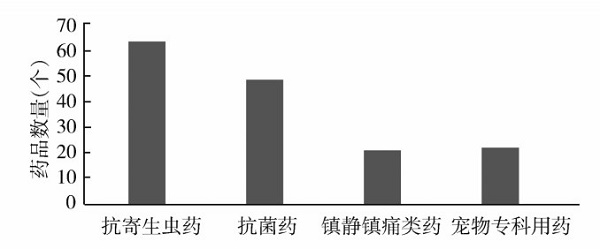
图2 2018年1月至2024年3月FDA
原始批准的不同用途的药品数量